研究内容
snRNA, scaRNAの生合成経路と関連疾患
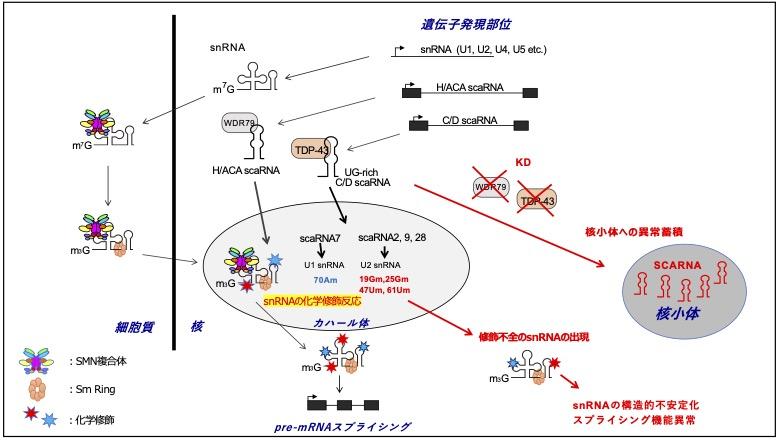
1. U snRNA、scaRNAの生合成経路の研究
U snRNAの成熟化に必要な化学修飾反応で機能するscaRNA(カハール体局在低分子RNA)について注目し、scaRNAの合成経路や局在異常により生じるsnRNAの化学修飾異常と、それによるスプライシング反応の異常が引き起こす細胞への影響を解析しています。
U snRNAやscaRNAの成熟化に関わるSMN、TDP-43、WDR79などのタンパク質群は、脊髄性筋委縮症(SMA)、筋萎縮性側索硬化症(ALS)、先天性角化異常症など、神経変性疾患を始めとした様々な疾患に関係しており、そうした疾患の発症機序と治療法のアプローチを明らかにできるよう、研究を進めています。
2. U-rich低分子核内RNA(U snRNA)
pre-mRNAのスプライシング反応を担うスプライソソームは、U-rich低分子核内RNA(U snRNA)と結合するタンパク質群により構成されています。一般的なスプライシング(メジャー・スプライシング)では、5種類のU snRNA(U1, U2, U4, U5, U6 snRNA)が構成因子であり、マイナー・スプライシングではU snRNA(U11, U12, U4atac, U5, U6atac snRNA)の5種類が機能しています。
snRNAはスプライソソームで使用されるまでに、細胞質と核内で多様な化学修飾を受けて成熟化される必要があります。 順を追って説明すると、核内で前駆体として転写されたsnRNAは細胞質へ輸送され、SMN複合体や7種類のSmタンパク質がリング状に連なったSm Ringと呼ばれるタンパク質群と結合することで、3’末端のプロセシング(部分的な切断)と、5’末端の修飾(トリメチルグアノシン化修飾)を経て核内へ再輸送されます。
核内ではカハール体と呼ばれる膜を持たない構造体に輸送され、ここでカハール体低分子RNA(scaRNA)を含む化学修飾酵素複合体により、適切な化学修飾が施されます。これらの輸送と化学反応プロセスをU snRNAの成熟化と呼び、成熟化されたU snRNAは完全体として、スプライシングの場へ輸送されることでスプライシング反応で機能します。
3. カハール体低分子RNA(scaRNA)
ここでscaRNAについて話を移すと、scaRNAはカハール体局在する低分子RNAとして知られ、現在まで28種類のscaRNAが報告されています。また、scaRNAは大別して、メチル化反応酵素群と複合体を形成するbox C/Dタイプ scaRNAと、シュードウリジン化反応酵素群と複合体を形成するbox H/ACAタイプ scaRNAの2種類に分けられます。
scaRNAは核内で転写された後にカハール体へ輸送されますが、この輸送を担うタンパク質として、scaRNAの構造内にCAB boxと呼ばれる配列を持つものはWDR79(別名TCAB1)に、構造内にUG-rich配列を持つものはTDP-43により輸送されます。カハール体へ輸送されたscaRNAは、同じくカハール体へ輸送されたU snRNAと出会い、適切な化学修飾(メチル化や、シュードウリジン化)を付与することで、U snRNAの成熟化に貢献しています。
(図では、U1 snRNAの70番目のAのメチル化(70Am)を担うscaRNA7、 U2 snRNAの19Gm,25Gm 47Um, 61Umを担うscaRNA2,9,28を例として示しています)
ここでWDR79 やTDP-43の何らかの異常により、scaRNAが適切にカハール体に輸送されなくなった場合、U snRNAは正確な化学修飾を受けることができず、未完成のままスプライソソームで使用されることが分かっています。未完成のU snRNAは安定性が失われ分解されやすくなったり、本来スプライシングされるべきpre-mRNAのスプライシングが起きないなど、細胞レベルでの遺伝子発現パターン(トランスクリプトーム)に対する問題に発展することが分かっています。
WDR79 やTDP-43の何らかの異常というのは、実際に様々な疾患で見られます。先天性角化異常症では、本来核内にいるはずのWDR79は遺伝子変異により細胞質に蓄積し、筋萎縮性側索硬化症(ALS)では、TDP-43は同様に遺伝子変異により細胞質に蓄積し、核内での本来の機能を果たせなくなることが分かっています。
また、カハール体に輸送されなくなったscaRNAは、別の核内構造体である核小体(リボソームRNAの生合成の場)に蓄積することが分かっています。これにより核小体で、リボソームRNAに対し本来生じないはずの化学修飾を付与し、リボソームの異常にまで発展していると主張している研究者グループもいます。
以上のように、scaRNAの正常なカハール体での機能と、U snRNAの成熟化は細胞にとって必須の経路であり、その異常は、これまで分かっていない(疾患と関連する)新たな分子メカニズムがあると考えています。
長浜研では、scaRNAに焦点をあて、scaRNAが転写からカハール体で機能するまでの分子メカニズムと、機能破綻による細胞レベルへの影響を研究することで、将来的な疾患への新たな治療アプローチになることを期待して研究に取り組んでいます。
Ref.
・Izumikawa K et al. 2025. RNA biology. 22(1):1-12. DOI: 10.1080/15476286.2025.2513133
・Izumikawa K et al. (2019) Nucleic Acids Res, 47, 2487-2505. DOI: 10.1093/nar/gkz086.
・Ishikawa H. et al. (2018) RNA Biology, 15, 261-268.
・Chao Xu et al. (2016) Genes and Development. 30:2376-2390.
・Ishikawa H et al. (2014) Nucleic Acids Research. 42:2708-24.